1. Lengkapi dan isilah titik-titik berikut!
2. Pehatikan Reaksi berikut!
a. Menurut teori asam basa Bronsted Lowry, mengapa H2O dan HCO3- bertindak sebagai asam?b. Menurut teori asam Basa Bronsted Lowry, mengapa NH3 dan H2O, bertindak sebagai basa?
c. Dari reaski 1 dan 2, masing-masing reaksi terdapat dua pasangan asam basa konjugasi, jika ditinjau dari keberadaan ion H+ pada keadaan awal dan akhir , maka:
Asam konjugasi adalah .....
Basa konjugasi adalah ......
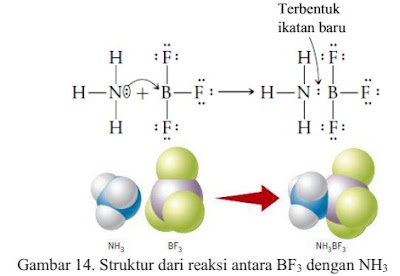
3. Perhatikan gambar 14 dan 15!
a. Spesi apa saja yang memiliki pasangan elektron besas?
b. Berdasarkan transfer pasangan elektron yang terjadi pada gembar 14 dan 15, diketahui bahwa BF3 dan HCl merupakan asam,. Bagimanakah definisi asam menurut Teori Lewis?
a. Spesi apa saja yang memiliki pasangan elektron besas?
b. Berdasarkan transfer pasangan elektron yang terjadi pada gembar 14 dan 15, diketahui bahwa BF3 dan HCl merupakan asam,. Bagimanakah definisi asam menurut Teori Lewis?
c. Berdasarkan transfer pasangan elektron yang terjadi pada gembar 14 dan 15, diketahui bahwa NH3 merupakan basa. Bagimanakah definisi basa menurut Teori Lewis?
4.Hitunglah pH larutan Ba(OH)2 0,05 M!
5. Hitung konsentrasi H+ dan OH- dari H2SO4 0,05 M dan Ca(OH)2 0,0050 M!
Petunjuk..!!
Terdiri dari 5 soal dan di kerjakan di atas kertas ukuran A4!
Jawaban kalian harus scan atau di photo dengan jelas tanpa ada latar meja atau sejenisnya.
Pengumpulan ulangan melalui email: learn_brisbane11@yahoo.co.id
Selamat bekerja















0 komentar:
Posting Komentar