Kimia XI MIPA/ II
LARUTAN
PENYANGGA (BUFFER)
Oleh:
Yunus Adiantor
Pengertian
Larutan Penyangga
Larutan penyangga adalah
suatu sistem larutan yang dapat mempertahankan nilai pH larutan agar tidak
terjadi perubahan pH yang berarti oleh karena penambahan asam atau basa maupun
pengenceran. Larutan ini disebut juga dengan larutan buffer atau dapar.
Dalam kehidupan sehari-hari, terdapat berbagai
reaksi kimia yang merupakan reaksi asam basa. Sebagai contoh, reaksi beberapa
enzim pencernaan dalam sistem biologis. Enzim pepsin yang berfungsi memecah
protein dalam lambung hanya dapat bekerja optimal dalam suasana asam, yakni
pada sekitar pH 2. Dengan kata lain, jika enzim berada pada kondisi pH yang jauh
berbeda dari pH optimal tersebut, maka enzim dapat menjadi tidak aktif bahkan
rusak. Oleh karena itu, perlu ada suatu sistem yang menjaga nilai pH di mana
enzim tersebut bekerja. Sistem untuk mempertahankan nilai pH inilah yang
disebut dengan larutan penyangga. Hal ini terjadi sebagaimana dalam larutan ini
terdapat zat-zat terlarut bersifat “penahan” yang terdiri dari komponen asam
dan basa. Komponen asam akan menahan kenaikan pH sedangkan komponen basa akan
menahan penurunan pH.
Fungsi Larutan Penyangga
Larutan penyangga banyak digunakan dalam analisis kimia, biokimia dan mikrobiologi. Selain itu, dalam bidang industri, juga banyak digunakan pada proses seperti fotografi, electroplating (penyepuhan), pembuatan bir, penyamakan kulit, sintesis zat warna, sintesis obat-obatan, maupun penanganan limbah.
Di dalam tubuh makhluk hidup juga terdapat larutan
penyangga yang sangat berperan penting. Dalam keadaan normal, pH darah manusia
yaitu 7,4. pH darah tidak boleh turun di bawah 7,0 ataupun naik di atas 7,8 karena
akan berakibat fatal bagi tubuh. pH darah dipertahankan pada 7,4 oleh larutan
penyangga karbonat-bikarbonat (H2CO3/HCO3−) dengan menjaga perbandingan konsentrasi [H2CO3]: [HCO3−] sama dengan 1:
20. Selain itu, dalam cairan intra sel juga terdapat larutan penyangga
dihidrogenfosfat-monohidrogenfosfat (H2PO4−/HPO42−). Larutan
penyangga H2PO4−/HPO42− juga terdapat dalam air ludah, yang berfungsi
untuk menjaga pH mulut sekitar 6,8 dengan menetralisir asam yang dihasilkan
dari fermentasi sisa-sisa makanan yang dapat merusak gigi.
Komponen
Larutan Penyangga
Larutan
penyangga asam
Larutan buffer asam mempertahankan pH pada suasana
asam (pH < 7). Larutan buffer asam terdiri dari komponen asam lemah (HA) dan
basa konjugasinya (A−). Larutan seperti ini dapat
diperoleh dengan:
1. mencampurkan
asam lemah (HA) dengan garam basa konjugasinya (LA, yang dapat terionisasi
menghasilkan ion A−)
2. mencampurkan
suatu asam lemah dalam jumlah berlebih dengan suatu basa kuat sehingga bereaksi
menghasilkan garam basa konjugasi dari asam lemah tersebut.
Contoh: larutan penyangga yang mengandung CH3COOH dan CH3COO−
Dalam larutan tersebut, terdapat kesetimbangan:
CH3COOH(aq) ⇌ CH3COO−(aq) + H+(aq)
Pada penambahan asam (H+),
kesetimbangan akan bergeser ke arah kiri, sehingga reaksi mengarah pada
pembentukan CH3COOH. Dengan kata lain, asam
yang ditambahkan akan dinetralisasi oleh komponen basa konjugasi (CH3COO−).
Pada penambahan basa (OH−), kesetimbangan akan bergeser ke arah kanan, yakni
reaksi pembentukan CH3COO− dan
H+, sebagaimana untuk mempertahankan konsentrasi ion H+ yang menjadi berkurang karena OH− yang ditambahkan bereaksi dengan H+ membentuk H2O. Dengan kata
lain, basa yang ditambahkan akan dinetralisasi oleh komponen asam lemah (CH3COOH).
Larutan
penyangga basa
Larutan buffer basa mempertahankan pH pada suasana
basa (pH > 7). Larutan buffer basa terdiri dari komponen basa lemah (B) dan
basa konjugasinya (BH+). Larutan seperti ini dapat
diperoleh dengan:
1. mencampurkan
basa lemah (B) dengan garam asam konjugasinya (BHX, yang dapat terionisasi
menghasilkan ion BH+)
2. mencampurkan
suatu basa lemah dalam jumlah berlebih dengan suatu asam kuat sehingga bereaksi
menghasilkan garam asam konjugasi dari basa lemah tersebut.
Contoh: larutan penyangga yang mengandung NH3 dan NH4+
Dalam larutan tersebut, terdapat kesetimbangan:
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH−(aq)
Pada penambahan asam (H+),
kesetimbangan akan bergeser ke arah kanan, yakni reaksi pembentukan NH4+ dan OH−, sebagaimana untuk mempertahankan konsentrasi ion
OH− yang menjadi berkurang karena H+ yang ditambahkan bereaksi dengan OH− membentuk H2O. Dengan kata
lain, asam yang ditambahkan akan dinetralisasi oleh komponen basa lemah (NH3).
Pada penambahan basa (OH−), kesetimbangan akan bergeser ke arah kiri,
sehingga reaksi mengarah pada pembentukan NH3 dan air.
Dengan kata lain, basa yang ditambahkan akan dinetralisasi oleh komponen asam
konjugasi (NH4+).
pH
Larutan Penyangga
Larutan
penyangga asam
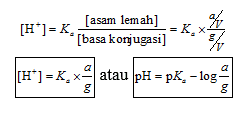
Dalam larutan buffer asam yang mengandung CH3COOH dan CH3COO−, terdapat kesetimbangan:
CH3COOH(aq) ⇌ CH3COO−(aq) + H+(aq)
Setelah disusun ulang, persamaan pH larutan di atas
akan menjadi persamaan larutan penyangga yang dikenal sebagai persamaan
Henderson – Hasselbalch sebagaimana persamaan berikut ini:
Jika a = jumlah mol asam lemah, g = jumlah mol basa
konjugasi, dan V = volum larutan penyangga,
Larutan
penyangga basa
Dalam larutan buffer basa yang mengandung NH3 dan NH4+, terdapat kesetimbangan:
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH−(aq)
Jika b = jumlah mol basa lemah, g = jumlah mol asam
konjugasi, dan V = volum larutan penyangga,
Contoh
Soal Larutan Penyangga
Tentukan pH larutan penyangga yang dibuat dengan
mencampurkan:
1.
10 mL
larutan CH3COOH 0,1 M dengan 10 mL larutan CH3COONa 1 M
2.
b. 20 mL
larutan CH3COOH 0,1 M dengan 10 mL larutan KOH 0,1 M
3.
c. 40 mL
larutan NH3 0,1 M dengan 4 mL larutan NH4Cl 0,1 M
Ka CH3COOH = 1 × 10−5; Kb NH3 = 1 × 10−5
Jawab:
1.
Larutan
penyangga dengan CH3COOH sebagai asam lemah dan CH3COONa sebagai garam basa konjugasi
a = mol
CH3COOH = 10 mL × 0,1 mmol/mL = 1 mmol
g = mol
CH3COO− = mol CH3COONa = 10 mL × 1 mmol/mL = 10 mmol
2.
0 mL
larutan basa kuat KOH 0,1 M (1 mmol KOH) akan bereaksi dengan 20 mL larutan
asam lemah CH3COOH 0,1 M (2 mmol CH3COOH) menghasilkan air dan garam basa konjugasi CH3COOK.
CH3COOH(aq) + OH−(aq) ⇌ CH3COO−(aq) + H2O(l)
3.
Larutan
penyangga dengan NH3 sebagai basa lemah dan NH4Cl sebagai garam asam konjugasi
b = mol
NH3 = 40 mL × 0,1 mmol/mL = 4 mmol
g = mol
NH4+ = mol NH4Cl = 4 mL × 0,1 mmol/mL = 0,4 mmol

















0 komentar:
Posting Komentar